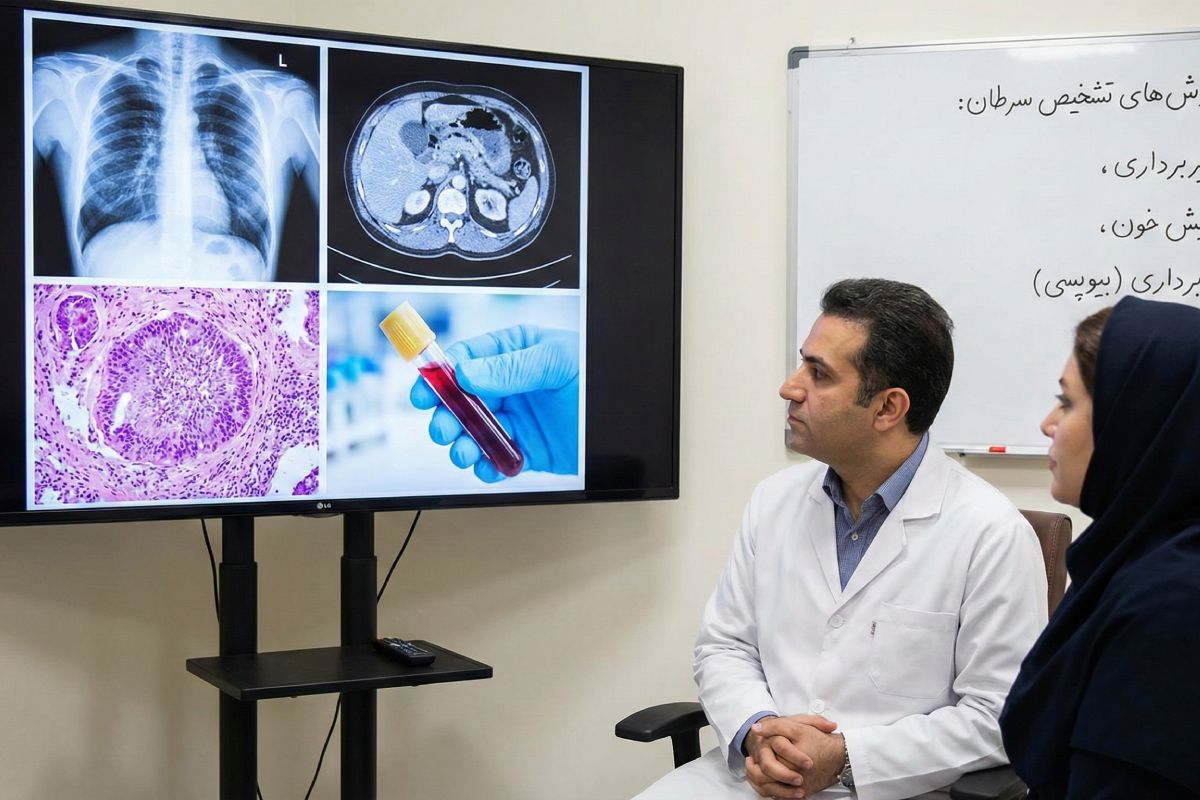
انواع روش های تشخیص سرطان
روشهای تشخیص سرطان، مجموعهای گسترده و هماهنگ از ارزیابیهای بالینی، آزمایشگاهی، تصویربرداری و مولکولی هستند که پزشکی مدرن برای شناسایی دقیق و مشخص کردن ویژگیهای بیماری سرطان به کار میگیرد. در گذشته، واژه “سرطان” یک مفهوم یکپارچه و ترسناک بود، اما امروزه میدانیم که با صدها نوع بیماری مختلف روبرو هستیم که هر کدام شخصیت بیولوژیکی، مسیر رشد و پاسخ متفاوتی به درمان دارند. به همین دلیل، تشخیص این بیماری دیگر یک اقدام واحد نیست، بلکه یک فرآیند کارآگاهی پیچیده و چندمرحلهای است.
این مسیر تشخیصی، که نیازمند همکاری تیمی از متخصصان مختلف (تومور بورد) است، از اولین گفتگو با پزشک آغاز شده و تا پیشرفتهترین آنالیزهای ژنومی ادامه مییابد. هر یک از این روشها، نوری بر جنبهای تاریک از بیماری میتاباند تا در نهایت، تصویری واضح و کامل برای انتخاب هوشمندانهترین استراتژی درمانی شکل گیرد. این مقاله به عنوان یک راهنمای جامع، به تشریح عمیق این روشها و منطق بالینی پشت هر کدام میپردازد.
چرا تشخیص زودهنگام سرطان اهمیت دارد؟
پاسخ به این سوال، اساس و شالوده بسیاری از استراتژیهای مبارزه با سرطان در سراسر جهان است. اهمیت تشخیص زودهنگام سرطان را میتوان در تاثیر مستقیم آن بر “مرحله” یا “Stage” بیماری خلاصه کرد. پزشکان از سیستم مرحلهبندی TNM (تومور، گره لنفاوی، متاستاز) برای توصیف میزان پیشرفت سرطان استفاده میکنند. تومور (T) به اندازه تومور اولیه، گره لنفاوی (N) به درگیری غدد لنفاوی مجاور، و متاستاز (M) به گسترش سرطان به نقاط دوردست بدن اشاره دارد.
یک سرطان در مرحله I (مثلاً T1N0M0) کوچک، محدود به محل اولیه و بدون هیچگونه گسترشی است. در مقابل، یک سرطان در مرحله IV (مثلاً T4N2M1) بزرگ، با درگیری گسترده غدد لنفاوی و متاستاز به اندامهای دیگر است.
تشخیص زودهنگام به معنای شناسایی بیماری در مراحل پایینتر است. در این مراحل، درمانها به مراتب موثرتر، کمتهاجمیتر و با عوارض جانبی کمتر هستند. برای مثال، یک پولیپ سرطانی در روده بزرگ که در مرحله اولیه و طی یک کولونوسکوپی غربالگری شناسایی میشود، ممکن است به طور کامل با همان کولونوسکوپی برداشته شود و بیمار به درمان دیگری نیاز نداشته باشد. حال همان سرطان را در نظر بگیرید که دیر تشخیص داده شده و به کبد متاستاز داده است (مرحله IV).
در این حالت، بیمار به جراحیهای وسیع، دورههای متعدد شیمیدرمانی سیستمیک و شاید درمانهای دیگر نیاز خواهد داشت که همگی کیفیت زندگی را تحت تاثیر قرار داده و شانس بهبودی کامل را به شدت کاهش میدهند. بنابراین، تشخیص به موقع، کلید تبدیل سرطان از یک بیماری بالقوه کشنده به یک بیماری قابل مدیریت و اغلب قابل درمان است.
آزمایشهای خونی در تشخیص سرطان
آزمایشهای خون به ندرت میتوانند به تنهایی سرطان را تشخیص دهند، اما نقش آنها به عنوان ابزارهای غربالگری، کمکی و نظارتی در میان روش های تشخیص سرطان بسیار حیاتی است. این آزمایشها میتوانند اولین سرنخها را فراهم کرده و پزشک را به سمت بررسیهای دقیقتر هدایت کنند.
یکی از قدیمیترین و رایجترین آزمایشها، شمارش کامل سلولهای خون (CBC) است. این تست ساده میتواند اطلاعات مهمی ارائه دهد. برای مثال، در سرطانهای خون مانند لوسمی یا لنفوم، ممکن است تعداد گلبولهای سفید به شدت افزایش یا کاهش یابد. همچنین، اگر سرطان به مغز استخوان، یعنی کارخانه تولید سلولهای خونی، نفوذ کرده باشد، میتواند باعث کاهش تولید گلبولهای قرمز (کمخونی) یا پلاکتها (خطر خونریزی) شود.
دسته دیگر، آزمایشهای بیوشیمی خون هستند. این پنلها عملکرد اندامهای حیاتی مانند کبد و کلیه را بررسی میکنند. نتایج غیرطبیعی، مانند افزایش آنزیمهای کبدی، میتواند نشاندهنده گسترش (متاستاز) سرطان به کبد باشد. همچنین، برخی سرطانها میتوانند موادی تولید کنند که سطح کلسیم خون را به شکل خطرناکی بالا ببرند.
شاید شناختهشدهترین آزمایشهای خون در این زمینه، تومور مارکرها باشند. اینها پروتئینها یا موادی هستند که توسط سلولهای سرطانی تولید شده و در خون آزاد میشوند. برای مثال، PSA برای سرطان پروستات و CEA برای سرطان روده بزرگ کاربرد دارند. با این حال، این مارکرها محدودیتهای جدی دارند. حساسیت و ویژگی آنها اغلب پایین است؛ یعنی ممکن است در مراحل اولیه سرطان افزایش نیابند (منفی کاذب) یا به دلیل شرایط غیرسرطانی مانند التهاب یا عفونت بالا بروند (مثبت کاذب). به همین دلیل، بیشتر برای پایش پاسخ به درمان یا بررسی عود بیماری پس از درمان به کار میروند تا تشخیص اولیه.
بیوپسی (نمونهبرداری)
در جهان پیچیده روشهای تشخیص سرطان، بیوپسی یا نمونه برداری، حرف آخر را میزند و به عنوان “استاندارد طلایی” شناخته میشود. تقریباً برای تمام سرطانهای توپر (Solid Tumors)، تا زمانی که نمونهای از بافت مشکوک توسط یک متخصصص آسیبشناسی (پاتولوژیست) زیر میکروسکوپ بررسی نشود، تشخیص قطعی نیست. در این فرآیند، نمونه کوچکی از بافت یا سلول از ناحیه مشکوک برداشته میشود.
پس از نمونه برداری، نمونه به آزمایشگاه پاتولوژی ارسال میشود. در آنجا، فرآیندی دقیق برای آمادهسازی بافت انجام میشود. نمونه در موادی تثبیت شده، در قالبهای پارافینی قرار گرفته، به لایههای بسیار نازک (به ضخامت چند میکرون) برش داده شده و با رنگهای مخصوصی رنگآمیزی میشود. این رنگآمیزیها به پاتولوژیست کمک میکند تا ساختار سلولها، هسته، سیتوپلاسم و نحوه آرایش آنها در کنار یکدیگر را به وضوح ببیند. پاتولوژیست به دنبال مشخصههای سلولهای سرطانی میگردد: هستههای بزرگ و نامنظم، از دست دادن ساختار طبیعی بافت، و شواهد تقسیم سلولی کنترلنشده.
گزارش پاتولوژی، سندی حیاتی است که نه تنها وجود سرطان را تایید یا رد میکند، بلکه اطلاعات کلیدی دیگری را نیز ارائه میدهد: نوع دقیق سرطان (مثلاً آدنوکارسینوما، کارسینومای سلول سنگفرشی، سارکوم)، درجه تهاجمی بودن آن (Grade)، و اینکه آیا سلولهای سرطانی به عروق خونی یا لنفاوی مجاور نفوذ کردهاند یا خیر. همه این اطلاعات برای برناهه ریزی درمانی ضروری هستند.
معاینه فیزیکی و بررسی علائم بالینی
سفر تشخیصی سرطان اغلب از مطب پزشک و با یک گفتگوی دقیق و معاینه فیزیکی کامل آغاز میشود. این مرحله به ظاهر ساده، در حقیقت یکی از مهمترین و هنرمندانهترین بخشهای پزشکی است. پزشک با پرسیدن سوالات هدفمند، به دنبال علائم هشداردهندهای میگردد که ممکن است بیمار به سادگی از کنار آنها گذشته باشد. این علائم که به “علائم قرمز” (Red Flags) معروفند، میتوانند شامل موارد زیر باشند: کاهش وزن غیرارادی (نشاندهنده مصرف بالای انرژی توسط سلولهای سرطانی)، خستگی عمیق و مداومی که با استراحت بهبود نمییابد، تعریق شبانه شدید، دردهای مداوم و بیدلیل، یا تغییرات پایدار در عملکرد طبیعی بدن (مانند تغییر در عادات روده یا سرفه مزمن).
در ادامه، معاینه فیزیکی دقیق انجام میشود. پزشک با نگاه کردن، لمس کردن و گوش دادن، به دنبال نشانههای فیزیکی بیماری میگردد. این نشانهها میتواند شامل یک توده قابل لمس در سینه یا بیضه، یک غده لنفاوی متورم و سفت در گردن یا زیر بغل، زردی پوست (که میتواند نشانه مشکل در کبد یا پانکراس باشد)، تغییر در ظاهر یک خال پوستی، یا شنیدن صداهای غیرطبیعی در ریهها باشد. یافتههای این مرحله اولیه، نقشه راه پزشک را برای مراحل بعدی ترسیم میکند و به او کمک میکند تا تصمیم بگیرد کدام آزمایشهای خون یا روشهای تصویربرداری را برای بیمار درخواست دهد.
تستهای ژنتیکی و مولکولی
اگر بیوپسی به ما میگوید که با سرطان روبرو هستیم، تستهای ژنتیکی و مولکولی به ما میگویند که این سرطان چه شخصیتی دارد. این حوزه پیشرفته، پزشکی سرطان را از درمانهای یکسان برای همه (One-size-fits-all) به سمت درمانهای کاملاً شخصیسازیشده سوق داده است. این آزمایشها که بر روی نمونه تومور انجام میشوند، به بررسی DNA، RNA و پروتئینهای سلولهای سرطانی میپردازند.
یکی از قدرتمندترین ابزارها در این زمینه، توالییابی نسل جدید (NGS) است. این تکنولوژی به دانشمندان اجازه میدهد تا کد ژنتیکی کامل سلولهای سرطانی را بخوانند و تمام جهشهایی که باعث سرطانی شدن آنها شده است را شناسایی کنند. هدف اصلی، یافتن “جهشهای قابل هدفگیری” (Actionable Mutations) است. اینها جهشهایی هستند که داروهای هوشمند و هدفمند خاصی برای آنها ساخته شده است. برای مثال، شناسایی جهش EGFR در سرطان ریه یا جهش HER2 در سرطان سینه، به انکولوژیست اجازه میدهد تا دارویی را تجویز کند که به طور خاص فقط به سلولهای سرطانی حامل آن جهش حمله میکند و آسیب کمتری به سلولهای سالم میرساند. این رویکرد، اثربخشی درمان را به شدت افزایش و عوارض جانبی را کاهش میدهد. این تستها همچنین میتوانند به پیشبینی احتمال پاسخ بیمار به ایمونوتراپی نیز کمک کنند.
روشهای تصویربرداری برای تشخیص سرطان
روشهای تصویربرداری پنجرههایی به درون بدن هستند که به پزشکان اجازه میدهند بدون نیاز به جراحی، ساختارهای داخلی را مشاهده کنند. این ابزارها در مکانیابی تومور، تعیین ابعاد آن، ارزیابی درگیری ساختارهای مجاور و مهمتر از همه، بررسی گسترش بیماری به سایر نقاط بدن (مرحلهبندی) نقشی بیبدیل دارند.
• سیتی اسکن (CT Scan): این روش با استفاده از اشعه ایکس و کامپیوتر، تصاویر مقطعی دقیقی از بدن ایجاد میکند. با تزریق ماده حاجب وریدی، میتوان عروق خونی و اندامها را با وضوح بیشتری دید و تومورها را از بافت سالم تمایز داد. سیتی اسکن برای بررسی قفسه سینه، شکم و لگن بسیار عالی است.
• ام آر آی (MRI): این تکنیک با استفاده از میدان مغناطیسی قوی، تصاویری با کنتراست فوقالعاده از بافتهای نرم ارائه میدهد. به همین دلیل، برای تصویربرداری از مغز، نخاع، مفاصل و اندامهایی مانند پروستات و رحم، روش ارجح است. تکنیکهای خاصی مانند MRI دینامیک با تزریق ماده حاجب، میتواند به تشخیص ماهیت تودهها کمک کند.
• پت اسکن (PET Scan): pet اسکن یک روش عملکردی است. ترکیب آن با سیتی اسکن (PET/CT) به استاندارد طلایی برای مرحلهبندی بسیاری از سرطانها مانند لنفوم، ملانوم و سرطان ریه تبدیل شده است. این روش با نشان دادن فعالیت متابولیک، میتواند کانونهای سرطانی را در هر نقطه از بدن، حتی اگر بسیار کوچک باشند، شناسایی کند.
• ماموگرافی و سونوگرافی: ماموگرافی (با استفاده از اشعه ایکس با دوز پایین) روش اصلی غربالگری و تشخیص سرطان سینه است. سونوگرافی نیز اغلب به عنوان یک روش مکمل برای ارزیابی تودههای یافت شده در ماموگرافی یا معاینه و برای هدایت سوزن بیوپسی به کار میرود.
آیا پت اسکن قطعیترین روش تشخیص سرطان است؟
پاسخ کوتاه و قاطع به این سوال “خیر” است. این تصور اشتباه که پت اسکن به تنهایی میتواند سرطان را به طور قطعی تشخیص دهد، باید اصلاح شود. قطعیترین روش برای تایید ماهیت سرطانی یک بافت، همچنان بیوپسی و تحلیل پاتولوژی است.
نقش پت اسکن در این فرآیند، نقشی متفاوت اما فوقالعاده حیاتی است. pet اسکن یک ابزار بسیار حساس برای نقشهبرداری از فعالیت بیماری در سراسر بدن است. این روش به سوالات کلیدی پاسخ میدهد: “آیا در جایی از بدن فعالیت مشکوکی وجود دارد؟” و “اگر سرطان تایید شده، به کجاها گسترش یافته است؟”. اما پت اسکن محدودیتهایی نیز دارد. این روش نمیتواند نوع سلول را مشخص کند.
مهمتر از آن، ممکن است نتایج “مثبت کاذب” داشته باشد؛ یعنی شرایط غیرسرطانی مانند عفونتهای قارچی، بیماریهای التهابی (مانند سارکوئیدوز) یا حتی التهاب ناشی از جراحی یا پرتودرمانی اخیر نیز میتوانند باعث جذب بالای ردیاب شده و به اشتباه به عنوان سرطان تفسیر شوند. همچنین، برخی سرطانهای کند رشد یا با متابولیسم پایین، ممکن است در پت اسکن فعالیت چندانی نشان ندهند (منفی کاذب). بنابراین، پت اسکن یک راهنمای فوقالعاده برای مرحلهبندی و هدایت بیوپسی است، اما جایگزین آن نیست.
پزشک چگونه بهترین روش تشخیص را انتخاب میکند؟
انتخاب از میان انبوه روشهای تشخیصی، یک فرآیند تصادفی نیست. پزشکان از مسیرهای بالینی (Clinical Pathways) و الگوریتمهای تشخیصی مبتنی بر شواهد پیروی میکنند که برای هر نوع سرطان مشکوک، بهینه شدهاند. این فرآیند منطقی تضمین میکند که بیمار در هر مرحله، مناسبترین و کارآمدترین ارزیابی را دریافت کند.
به عنوان مثال، مسیر تشخیصی برای یک بیمار با شک به سرطان روده بزرگ را در نظر بگیرید:
1. ارزیابی اولیه: بیمار با علائمی مانند تغییر در عادات روده و مشاهده خون در مدفوع مراجعه میکند. پزشک پس از شرح حال و معاینه، به سرطان روده مشکوک میشود.
2. آزمایش اولیه: ممکن است یک آزمایش خون برای بررسی کمخونی و یک آزمایش نشانگر توموری CEA درخواست شود.
3. اقدام تشخیصی کلیدی: بهترین قدم بعدی، انجام کولونوسکوپی است. این روش به پزشک اجازه میدهد تا به طور مستقیم تمام سطح داخلی روده بزرگ را مشاهده کند.
4. بیوپسی: اگر در حین کولونوسکوپی، پولیپ یا تودهای مشکوک دیده شود، بلافاصله از آن نمونهبرداری (بیوپسی) میشود.
5. تایید پاتولوژی: نمونه به آزمایشگاه ارسال شده و پاتولوژیست وجود سلولهای سرطانی (آدنوکارسینوما) را تایید میکند.
6. مرحلهبندی (Staging): پس از تایید تشخیص، برای بررسی گسترش بیماری، یک سیتی اسکن از قفسه سینه، شکم و لگن انجام میشود.
این رویکرد گام به گام و منطقی، از انجام آزمایشهای غیرضروری جلوگیری کرده و بیمار را در سریعترین و دقیقترین مسیر به سمت تشخیص و درمان هدایت میکند.
جمع بندی
روشهای تشخیص سرطان، مجموعهای از ابزارهای مکمل هستند که در کنار یکدیگر، یک داستان کامل را روایت میکنند. این فرآیند، سمفونی هماهنگی از علم بالینی، تکنولوژیهای پیشرفته تصویربرداری، دقت میکروسکوپی پاتولوژی و بینش عمیق ژنتیک مولکولی است. از اولین معاینه فیزیکی که جرقهای از شک را در ذهن پزشک ایجاد میکند، تا گزارش نهایی پاتولوژی و پروفایل ژنتیکی تومور که نقشه راه درمان را ترسیم میکند، هر یک از این روشها نقشی غیرقابل جایگزین دارند. این رویکرد جامع و چندوجهی، سنگ بنای پزشکی سرطان مدرن است که به لطف آن، تشخیصها دقیقتر، درمانها موثرتر و آینده بیماران مبتلا به سرطان، روشنتر از هر زمان دیگری است.